意図しないイオン対試薬の場合
HPLCのルーチン分析において、同一バッチ内における保持時間のズレは悩みの種です。前号では、多くのHPLC法において、最初の数回の試料注入時に見られる保持のドリフトについて紹介しました。これは多くの場合、移動相あるいは試料成分のカラムに対する平衡化が遅いことと関係しており、しかも、大抵、最初の3、4回の試料注入の後には、この現象は見られなくなってしまいます。高濃度試料の注入により、多くの場合、上記のプロセスが加速することが分かっており、また、最初の1、2回の試料注入を無視する方法が、この問題に対処する最も簡単な方法です。
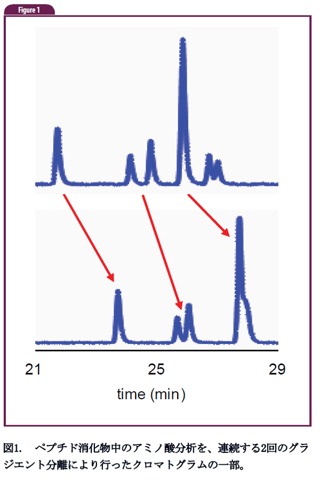
前号で紹介した保持時間のドリフトは、タンパク質やペプチドの分析においても一般的な現象であり、小さな試料分子に対して最も良く見られる現象は、保持時間のドリフトではなく、ピーク面積のドリフトであることを、ある読者の方(D.M.さん)からのご質問に対応した際に思い出しました。これは、連続して試料注入する際に、カラム内の活性部位が、毎回、少しずつ一部の試料と相互作用していくためであり、平衡化が遅い活性部位が試料によって完全に飽和状態になるまで起こります。従って、この現象の後に、ピーク面積が一定になります。保持時間のドリフトを引き起こす、もう一つの理由は、より潜在的な問題によるものです。私はこの現象を薬の錠剤の溶解をモニターする手法で見たことがあります。最近、読者の一人(T.S.さん)から、全く上記とは関係の無い系における、上記と同様の問題の報告がありました。彼はナノカラムを用いてペプチドの分析をしている時に、分析した試料総数が多くなっていくにつれて、保持時間が連続的に遅くなる現象を見つけました。図1は二つの連続するグランジエント分析で得られたクロマトグラムの一部を示しています。矢印で示す様に、各ピークに対する保持時間が最大で約2分程度まで増加しています。
私は、溶解試料の場合、連続して分析していくにつれて、毎回、保持時間が少しずつ増加する、上記と同様の問題を経験したことがあります。溶解槽は、胃の中での錠剤の溶解をシュミレーションするためにデザインされているため、溶解槽の中にはHCl、水だけでなく、その他多くの人の胃液成分を再現する成分が入れられています。この"魔法の薬"の中の一成分は、ラウリル硫酸ナトリウム(SLS)のような界面活性剤です。
イオン対試薬は、イオン性化合物の保持を増加させるために、しばしば移動相に加えられます。例えば、ヘキサンスルホン酸の様に、疎水基と負電荷を有している試薬が、陽イオン性の試料成分を保持させるために移動相に加えられます。イオン対形成のモデルの一つでは、試料分子の疎水性末端が、逆相カラムの疎水性の表面に引き寄せられますが、この時、試料分子のイオン化した末端が、より極性の移動相中へと突き出したままの状態です。すなわち、この場合には、逆の電荷を有する分析対象試料の保持に有効な、in situイオン交換表面を形成しています。
イオン対形成における最も大きな問題の一つは、イオン対試薬と固定相との間に平衡が生じると言うことです。この平衡化のプロセスはとても遅く、また、移動相中の有機溶媒含有率およびカラム温度に大きく影響されます。一般的に、私たちはカラム体積の約10倍程度の移動相をカラムに流せば、カラムが平衡化されていると考えています。これは、新しく調製した移動相をHPLCシステムにセットし、その移動相の送液をスタートしていれば、一般的に、最初の試料注入の準備ができるまでの時間に、カラムは既に平衡化されていると言うことです。しかし、イオン対形成の場合には、そうでは無く、平衡化には、カラム体積の20-50倍あるいはそれ以上の移動相送液が必要です。イオン対形成に基づく、ほとんどの分離アプリケーションは、移動相組成に敏感であるため、有機溶媒含有量が一定のアイソクラティック分離のみに制限されています。グラジエント条件下では、平衡に達しないでしょう。
SLSもイオン対試薬の一つです。また、無極性であり、逆相カラムに極めて強く相互作用します。溶解槽試料は極めてクリーンであるため、せいぜい希釈かろ過の試料前処理だけで、多くの場合試料は直接注入されます。これにより、各注入試料は微量のSLSを含んでおり、そしてSLSはカラムに徐々に蓄積されていきます。SLSは次々とカラムに注入されるため、カラム内に蓄積されて動かないイオン対試薬の濃度は、その後、毎回、試料注入により増加します。ある所で平衡に達しますが、それには、とても多くの試料注入が必要で、平衡に達することは、まずありません。その結果として、一般的な薬剤等の陽イオン性試料は逆相だけの保持ではなく、当然ながらイオン対によっても保持されます。イオン対試薬の量が絶えず変化するので、保持はいつまで経っても安定しないでしょう。
フォローアップメールにおいて、T.S.さんは試料精製プロセス後に注入試料中に残存していたドデシル硫酸ナトリウム(SDS)に由来する、ペプチドの保持時間のドリフトを見つけたと報告しています。彼の場合、SLSはイオン対試薬として働いており、カラム内に徐々に蓄積し、そして、徐々に塩基性アミノ酸の保持が増加しました。
これらの問題の解決策は何でしょうか?一つは分析プロセスから界面活性剤を排除することですが、現実的ではないでしょう。二つ目の方法は、界面活性剤を取り除くために試料前処理プロセスを改良する方法です。この方法は、手間はかかりますが、実行可能な方法です。私が行うであろう方法は、意図的に低濃度のイオン対試薬を移動相に加え、安定した保持時間が得られるか確認する方法です。この方法で、完全な平衡が達成されたかどうかを確認することができると思います。この最後の解決法は、グラジエント溶離を必要とするペプチド法に用いるのは困難でしょう。また、この方法は、容認できないような選択性の変化を引き起こすかもしれません。意図しないイオン対形成が起こると、美しい分析結果は、まず得られません。
図1. ペプチド消化物中のアミノ酸分析を、連続する2回のグラジエント分離により行ったクロマトグラムの一部。


